单细胞生物学近几年是非常热门的研究方向。在这一实验领域中的则是单细胞测序技术。传统测序方法一次处理成千上万个细胞,得到的变异水平也是成千上万个细胞的平均后水平。但是,就如同世界上没有完全相同的两片树叶一样,没有两个细胞是完全相同的。所以,单细胞测序对于研究单个细胞就显得至关重要。
单细胞测序可以揭示出每个细胞独特的微妙变化,甚至可以揭示全新的细胞类型。单细胞测序技术可谓是科技发展史上的一大创举,它推进了基因组学领域,使不同细胞类型得以精细区分,使得科学家们在单细胞水平进行分子机制研究成为可能。
随着高通量RNA测序技术的发展,2009年,开发了一个单细胞转录组测序技术。到了2011年Nicholas等人开发了单细胞基因组测序技术。2013年又开发出了单细胞全基因组DNA甲基化检测技术。随后,科学家在细胞分选技术、核酸扩增技术、信噪比提高方面等进行不断优化和改进,也进一步开创了单细胞Hi-C、单细胞ChIP-seq、单细胞ATAC-seq技术等。
2017年单细胞测序在技术水平和应用层面上都更进一步发展,本周我们汇总了2017年单细胞测序技术层面的部分重要进展。
SCI-seq
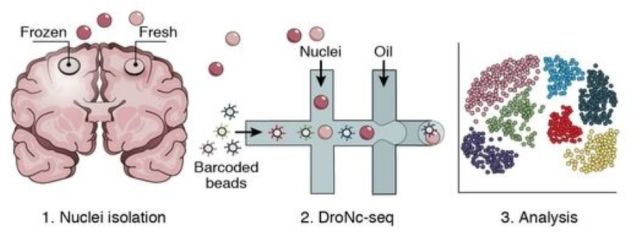
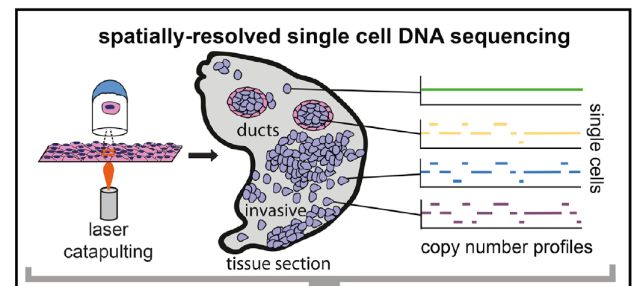
2017年3月,美国俄勒冈的研究人员在Nature Methods上发表“Sequencing thousands of single-cell genomes with combinatorial indexing (doi:10.1038/nmeth.4154) ”文章,开发出一种SCI-seq (single-cell combinatorial indexed sequencing,单细胞组合标记测序技术),多次对细胞进行条形码编码标记后对它们进行测序,可以同时构建上千个单细胞文库,检测体细胞拷贝数的变异。这项技术缩减了文库构建的成本,增加了检测细胞的数量,这对于体细胞变异的检测,尤其是在肿瘤进化过程中对细胞亚克隆变异研究具有重要价值。研究人员从培养的细胞系、灵长类额叶皮层组织和两个人类胰腺癌中构建了大约17000个单细胞基因组文库,这大约比利用常规方法能够构建出的基因组文库大小高出两个数量级。
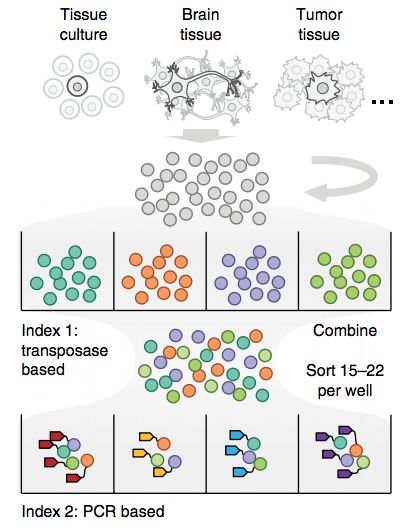
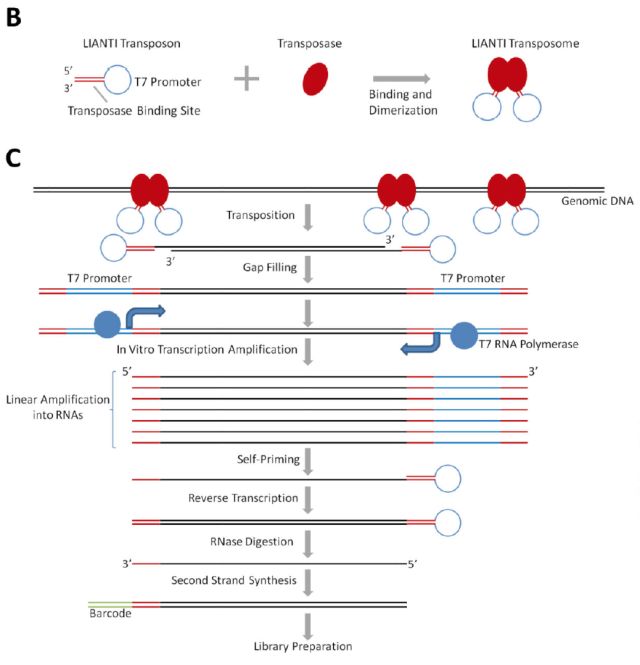
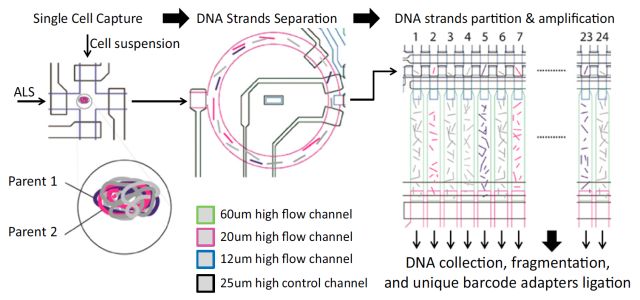
2017年4月北京大学谢晓亮教授团队在Science上发表“Single-Cell Whole Genome Analyses by Linear Amplification via Transposon Insertion (LIANTI) (doi: 10.1126/science.aak9787)”文章,开发一种新型的单细胞全基因组线性扩增的方法——;LIANTI(Linear Amplification with Transposon Insertion)用于单细胞全基因组测序。
LIANTI法通过转座子插入进行线性放大。基因组被含有T7启动子的Tn5转座子随机片段化 ,T7启动子允许线性扩增。LIANTI法测量拷贝数的空间分辨率提高了3个数量级(能在千碱基分辨率进行微小CNV检测,基因组覆盖率可达到97%),能直接观察从细胞到细胞不同的随机发生的DNA复制起始位点。他们用新方法检测了被紫外线照射过的单个人类细胞的单核苷酸突变,结果明显优于目前已知的其他方法。这意味LIANTI能更有效、准确地检测出更多疾病突变。
下一篇:单细胞测序:细分肿瘤亚型