2018年10月29日,北京大学未来基因诊断高精尖创新中心(ICG)、生命科学学院BIOPIC、北大-清华生命科学联合中心的张泽民研究组与美国安进公司欧阳文军团队及北京大学人民医院申占龙课题组合作在国际顶级杂志Nature在线发表了题为“Lineage tracking reveals dynamic relationships of T cells in colorectal cancer”的研究论文。
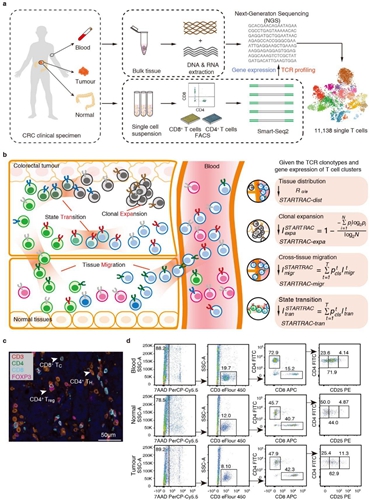
该研究开发了STARTRAC(Single T-cell Analysis by Rna-seq and Tcr TRACking)的生物信息学分析方法,利用该方法系统性地刻画了来自12个结直肠癌病人的大量T细胞的组织分布特性、克隆增生、迁移和状态转化关系(图1),是迄今为止国际上针对结直肠癌肿瘤微环境中单个T细胞规模深入的新颖性研究。此外,该研究发现了基因组微卫星不稳定(Microsatellite instable,MSI)和微卫星稳定(Microsatellite stable,MSS)病人间差异的CD4阳性T细胞新类群,并对新类群特异表达的协同刺激因子进行了功能阐释。该项工作为实验研究其他疾病中的T细胞以及开发新的治疗方案提供了思路。
肿瘤浸润T淋巴细胞在肿瘤免疫治疗中发挥核心作用。基于免疫检查点(如CTLA-4,PD-1/PD-L1)开发的抑制剂药物在多种癌症治疗中取得良好疗效,然而不同类型癌症病人的疗效迥异。
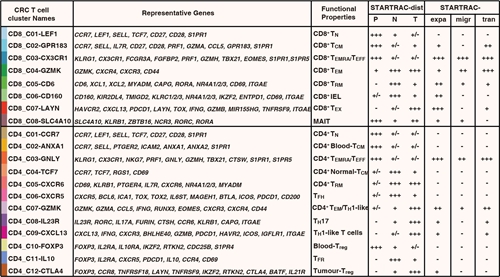
近期小鼠模型实验证明肿瘤外部的T细胞可以参与系统性抗肿瘤免疫反应 ,不同状态的CD8+T细胞对免疫检查点抑制剂的治疗效果差异显著,这暗示T细胞的迁移潜能和状态变化特性,可能对其抗击肿瘤发挥至关重要的作用。基于单细胞转录组学的研究在T细胞的亚型分类和分子图谱刻画上取得了一系列进展,而描绘人体内T细胞的动态变化一直是研究的难点。为攻克该研究难点,张泽民教授的研究团队开创性地利用T细胞受体(TCR)作为标签,开发了STARTRAC系统性的生物信息定量分析方法,利用该方法对结直肠癌病人癌组织、癌旁组织以及外周血中鉴定的20类不同类型T细胞进行追踪(图2),
取得了一系列新进展。研究发现除了肿瘤微环境外,TCR也会影响肿瘤浸润CD8+效应记忆T细胞(effector memory T cell)向“耗竭性T细胞 (exhausted T cell)”和效应T细胞的转化,该发现将有助于我们理解肿瘤微环境中耗竭性T细胞的来源,并为逆转其状态提供新的思路。
多项临床试验表明,MSI/dMMR(错配修复基因缺陷)结直肠癌病人对免疫检查点抑制剂的治疗响应显著优于MSS病人。
以往基于组织水平的研究发现,这两类结直肠癌病人有显著的T细胞基因表达差异,如IFNG和PDCD1,推测这种差异可能来自CD8 T细胞和TH1细胞。由于技术限制,对MSI和MSS结直肠癌病人差异类群的寻找和鉴定一直没有解决。该研究基于单细胞测序技术,发现MSS结直肠癌病人比MSI病人显著富集TH17细胞,而MSI病人中显著富集一群高表达CXCL13的TH1-like细胞。
值得注意的是,研究人员在结直肠癌癌组织中发现了两群高表达IFNG的CD4 TH1-like细胞,只有高表达CXCL13的亚群在MSI病人中显著富集。研究人员进一步发现,这两群TH1-like细胞具有不同的IFNG转录调控因子,其中BHLHE40不仅可以促进产生效应性的IFN-?分子,还可以产生抑制性的IL-10分子,提示CXCL13+ TH1-like细胞可能与免疫检查点抑制剂的治疗响应相关(图3)。
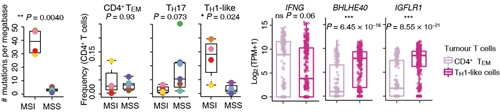
此外,该类群细胞高表达多种在肿瘤免疫中功能未知的膜表面蛋白,其中IGFLR1作为新的协同刺激因子,IGFLR1/IGFL3通路可作为潜在的药物治疗靶点。
文章摘自北京大学新闻网。
下一篇:单细胞微流体服务实验室