这篇我们要学习的是美国俄勒冈州卫生科学大学的Andrew Adey课题组开发的新型单细胞测序技术,SCI-seq,如何不需要用微流控和液滴分选就可以实现单细胞测序?这种新型的单细胞测序技术有何优势?
说起这种新的单细胞测序技术,需要先谈到Tn5插入的index方法,什么意思那?
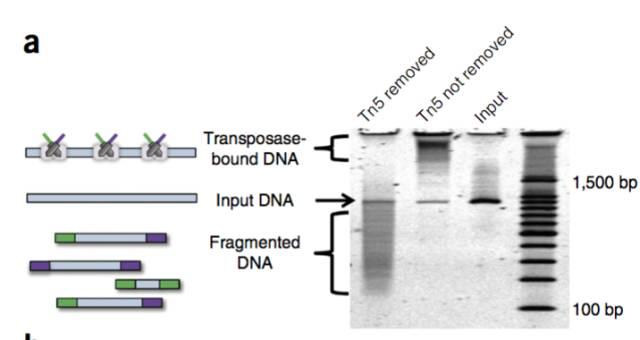
Tn5是一种转座酶,可以将DNA片段插入到基因组中,因此可以利用Tn5,将想要的序列插入到基因组,并且可以将基因组打断成相应的片段,并且在末端链接上想要的序列,如果我们在末端链接的序列上,使用不同的序列,因此便可以进行复杂的组合建库微流控。
那什么叫复杂建库那?
复杂建库的方法就是将PCR index引入的时候,和Tn5 index引入的时候,进行组合,从而可形成数十万种不同的index,而每一个细胞将会得到index,这也就是复杂建库的精髓所在。
那么如何将复杂建库应用在单细胞测序上哪?

其实两年前,便有科学家们着手这方面的研究,通讯作者Jay也就是本期单细胞微流控HiC的通讯作者。
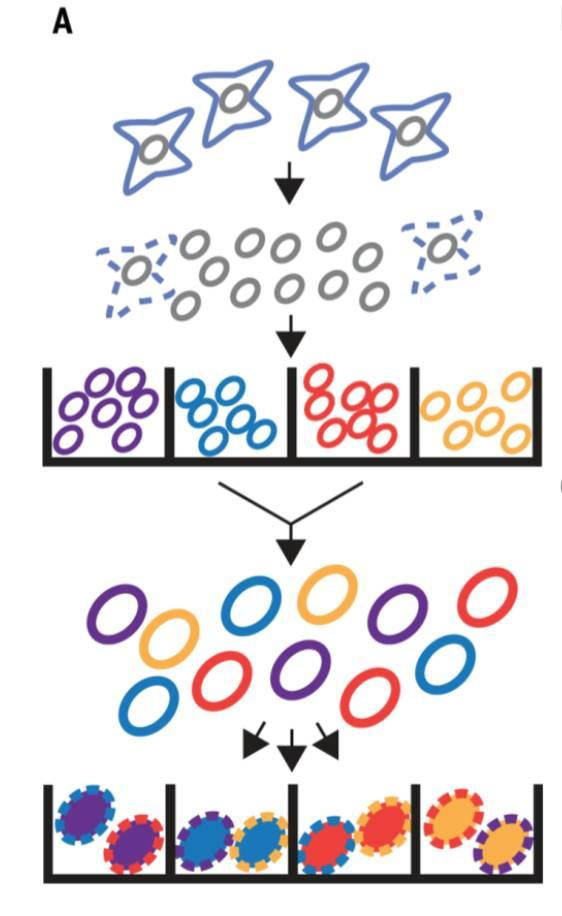
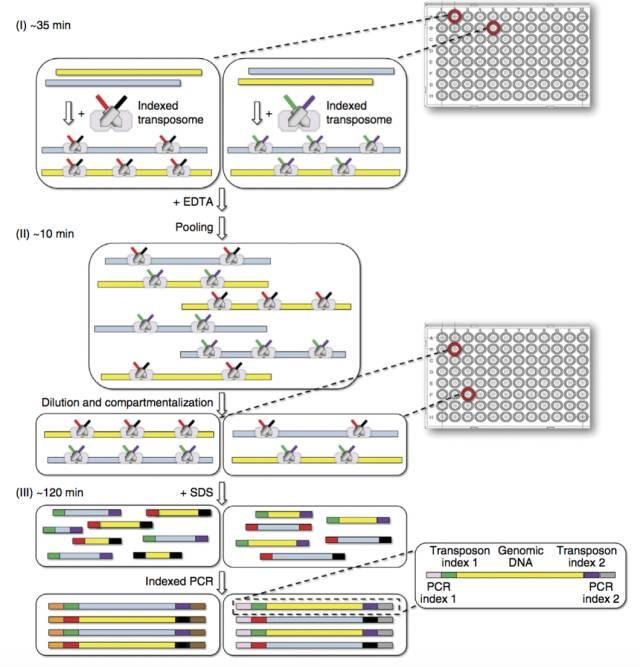
上图也就是复杂建库方法的精髓所在,需要先将细胞用FACS分选到96孔板中,让每个孔有25个左右的细胞,然后不同孔之间使用不同的Tn5对应的index,进行插入整合。这个时候,每个孔内细胞的index是一样的,而且细胞是完整的微流控。
然后再对细胞进行混合和重新分配,然后这样,在新的96孔板里面,每个细胞的index是不一样的,然后对每一个孔,裂解,加上PCR对应的index,这样就保证了每个细胞的index的微流控。
理解了这种index的复杂建库方法进行单细胞测序后,Jay在2014年这篇Science中开展的就是ATAC-seq,事实上,转座酶对染色体的插入并非均一的,而是插入在活性区域,这样便可以进行活性区域的判断。
然而,如果是想要单细胞DNA测序的话,这个便成了劣势,显然,如果有些区域无法插入,进而就无法建库,那么无法进行DNA覆盖。
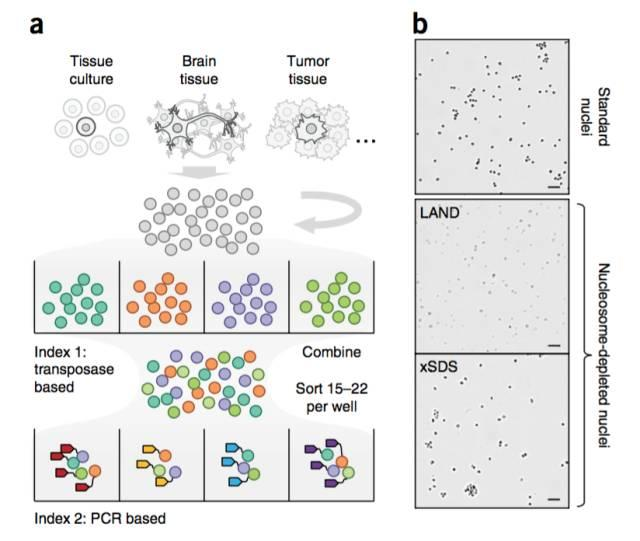
因此科学家们构思了一个非常巧妙的方法,第一种方案是通过锂辅助的核小体去除的方法,第二种是通过SDS然后欧联的方法。
通过这两种方法,可以看到在上图中,仍然保持细胞核的完整性。
然后用复杂建库的方法,进行测序,这个时候就可以获得更加平均插入的Tn5,index。
从这张图可以看到与标准的进行比对,LAND和xSDS两种方法,可以具有更加均衡的插入建库。
既然获得了这种方法,下面需要做的便是评价方法的适用情况,是否可以进行有效的基因组建库?与其他方法相比如何?
科学家们对测序的序列,进行分析,可以看到所有的细胞中,明显的分为两类,一类是具有重复序列很少,质量比较高,一类重复序列很多。显然前者更适合用于实验数据的分析。
那么是否真的是单细胞分析那?
科学家们将小鼠和人的细胞进行混合,这样,如果测到的细胞有小鼠和人细胞混合的reads,那么提示并非实验所获得的单细胞。不过这一类数据很少,提示确实是微流控单细胞数据。
那么测序数据的覆盖度如何那?
MAD和MAPD可以用于评价不同测序方法覆盖度的水平,分数越低越好,可以看到在两种评价标准中LAND都比xSDS差。
SCI-seq显著的应用便是用于基因组拷贝数情况的分析;针对于不同核型的细胞,科学家们对不同的方法进行分析:可以看到过滤后的数据而言,xSDS已经和DOP和QRP相差无几。
科学家们将这种微流控方法,应用于恒河猴的大脑染色体拷贝数分析,和癌症单细胞拷贝数分析:
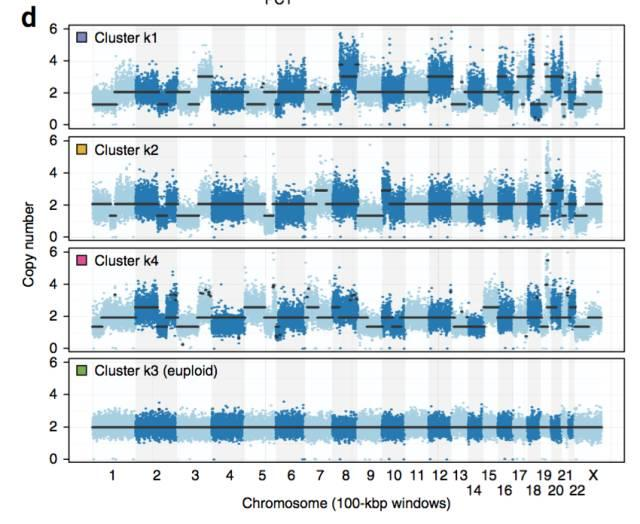
可以预见在不远的将来单细胞测序的费用越来越低,将成为人们解析更高层次的生命活动的基本手段。