常规的转录组分析方法通常需要103个细胞,所以无法揭示单个细胞之间基因表达的异质性,也难以对诸如早期胚胎及异质性的组织干细胞和肿瘤干细胞等少量细胞进行分析,而单细胞转录组测序技术的出现为此提供了有效的研究工具。单细胞转录组测序技术是在单细胞水平对全转录组进行扩增与测序的一项新技术。本文主要就单细胞转录组测序技术的操作方法、应用成果以及进展作一综述。
在过去的二三十年里,基因组测序技术快速发展,人类千人基因组计划和癌症基因组计划等大型测序项目相继开展。这些测序所使用的材料均为数百万个细胞的混合样本,虽能够得到为全基因组序列信息.但其结果显示的只是一群细胞中信号的平均值,或只代表其中占优势数量的细胞信息,对单个细胞间的差异却被忽视。对同一组织众多细胞的测序会生成多重数据,不利于追踪细胞病变过程和细胞间状态差异。
对临床上诸如循环肿瘤细胞、早期发育的胚胎细胞等含量少的细胞而言,混合细胞群样本·综述·的测序方法也已不再适用。2006年,zhang在“NatureBiotechnology”上发表文章先提出单细胞基因组测序技术,即在单个细胞水平对全基因组或转录组进行扩增与测序的一项新技术,这在近年取得突飞猛进的发展。本文就单细胞转录组测序的技术原理及应用进展作一综述。
1单细胞转录组测序技术
1.1单细胞转录组测序概述
转录组是指在某一特定阶段,由单细胞转录组测序出来的全部RNA.包括mRNA和非编码RNA[2‘3]。转录组学就是从IⅢA水平研究基因的表达情况,在整体水平上研究细胞中基因转录的情况及转录调控的规律。与基因组不同,转录组学研究包含了时间和空间的限定。同一细胞在不同的生长时期及生长环境下,其基因表达情况是不完全相同的。近几年兴起的单细胞测序技术可以在单细胞水平对全转录组进行扩增与测序,其原理是将分离的单个细胞的微量全转录组RNA进行扩增后进行高通量测序。利用该技术能够揭示单个细胞内整体水平的基因表达状态和基因结构信息,准确反映细胞间的异质性.深入理解其基因型和表型之间的相互关系。单细胞基因组技术已经应用到多个领域,如植物细胞、动物细胞(包括人体细胞)和微生物等。但是,单细胞基因组测序技术仍有3个关键技术点:单细胞分离技术、单细胞全基因组扩增技术、高通量测序技术。
1.2单细胞分离技术
进行单细胞转录组的测序,首先要对单个细胞进行分离分获得到单细胞样品。迄今为止,已经有多种技术方法被用于单细胞的分离,常用的单细胞分离方法主要有连续稀释法(se曲ldilution)、显微操作法(micromanipulation)、荧光流式分选法、激光捕获显微切割技术以及微流控平台(rnjcronuidicplatfoms)。这些方法各有利弊,所以要根据具体的情况选择合适的方法进行分离。
1.2.1连续稀释法
该技术通过将细胞进行一系列的倍比稀释,然后使细胞处于单个状态,已成功应用在不同组织的干细胞、前体细胞体外克隆形成分析的研究中[¨-s]。此方法操作简便,且不需要特殊的设备,但是依赖于梯度稀释计算,不是直观的单个细胞分离.容易出现错误。
1.2.2显微操作法
显微操作法是指在高倍倒置显微镜下,利用显微操作器(控制显微注射针在视野中移动的机械装置)进行细胞或早期胚胎等操作的一种技术方法。此技术主要应用于目标细胞所在的群体数量较少的样品分离中,能够高效地控制单个细胞的吸取和释放。
1.2.3荧光流式分选法
荧光流式分选法是一种通过流式细胞仪,根据细胞特异性分子标志或者细胞光散射的特性.分选单个细胞或者特殊细胞群的技术。此技术主要的优势在于能够选择特异和非特异的分选.并且在分离单细胞时具有很高的精度和通量。
1.2.4激光捕获显微切割技术
激光捕获显微切割技术[9]是选择性地将目标组织切片或细胞固定在装配有可以激光脉冲激活的热塑膜的涂片上,其中膜包括乙烯乙酸乙烯酯膜、聚对苯二甲酸乙二醇酯膜和聚萘二甲酸乙二醇酯膜等,显微镜直视下选择并激光切割目标细胞。应用此技术可以直观地在显微镜下准确、快速地获取单一细胞亚群或者单个细胞,解决了组织中细胞异质性的问题。该技术现已广泛应用于结肠癌、乳腺癌[u]、结核病[地]和丙型肝炎的研究中。

1.2.5微流控平台
与其他方法比较,微流控平台相结合单细胞测序技术在降低单细胞测序的噪声以及基因组扩展更加均匀方面具有优势,显示出了良好的应用前景。此外,微流体芯片的微量反应容积还提高了扩增的准确率和反应效率。许多实验室开始设计将微流控平台用于他们的研究对象,并且有微流控平台已经商品化。例如,F1uidigm公司新推出一款C1单细胞扩增仪器,其原理就是在微流控芯片中进行细胞裂解、反转录与cDNA扩增,再利用转座酶技术构建测序文库胁z川,显著提升了建库通量。
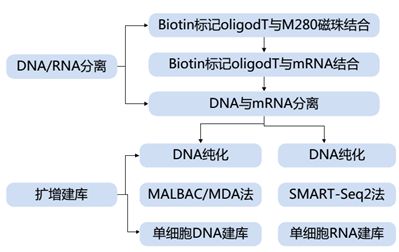
1.3单细胞全转录组cDNA扩增技术
全基因组扩增是单细胞转录组测序的关键步骤,对于形成足够量的DNA片段用于测序分析起着至关重要的作用。如今已研发出多种扩增方法.例如简并寡核苷酸引物PCR、引物延伸预扩增PcR、连接介导的PCR等。尤其近年发展起来的基于多重置换扩增和多次退火环状循环扩增单细胞测序,他们在全基因组扩增中有着较为广泛的应用。
1.3.1多重置换扩增技术
多重置换扩增技术是先由Dean等在2002年报道。多重置换扩增技术作为一种不依赖于PCR的全基因组扩增方法,近些年来得到广泛应用。该方法利用Phi29DNA聚合酶和随机六聚体引物对人基因组进行指数扩增,首先随机六碱基寡核苷酸作为引物在多个位点与基因组模板DNA退火,接下来Phi29DNA聚合酶在多个位点同时开始复制,沿着DNA模板合成DNA,同时取代模板的互补链。被置换的互补链又作为新的模板来进行扩增.形成一个级联分支的放大系统;可获得相对高分子质量的DNA。该反应在常温下扩增,避免了高温下DNA降解对扩增产物质量的影响及GC含量不同引发的优势扩增。但是此方法的扩增均匀性不高。多重置换扩增技术可用于单核苷酸多态性以及突变相关的研究。
1.3.2多次退火环状循环扩增技术
2012年12月,哈佛大学的研究团队在Science上发表介绍多次退火环状循环扩增技术的文章,该技术选用全基因组扩增技术。不同于以往的扩增方法。多次退火环状循环扩增能够从一个细胞的基因组中.分离出来自单细胞的DNA,然后添加特殊的引物,这些引物可与DNA的随意部分互补.从而使得它们能够附着到DNA链上,充当DNA复制起点。这些引物由两个部分构成——一个包含8个核苷酸的粘性部分变化多样.可与DNA结合,再加上一个包含27个核苷酸的共同序列。这一共同序列通过将自身掺人到新拷贝链,从而自身成环.防止了过度拷贝,从而大大地降低了扩增偏倚。提高了基因组覆盖率,可以使单细胞中93%的基因组被测序。另外,多次退火环状循环扩增的灵敏度较高。单细胞、单染色体或O.5pg的基因组DNA即可进行扩增.扩增的均匀性也显著优于其它单细胞转录组测序技术。该技术可用于那些样本较少,用常规方法无法进行基因组或转录组分析或者样本高度异质,细胞之间存在重要差异的样本。
1.4高通量测序技术
自2005年以来,以Roche公司的454技术、111uTnina公司的Solexa技术和ABI公司的SOLiD(supportedoligo1igationdetetion)技术为标志的高通量测序技术相继诞生。
高通量测序技术是测序技术发展的一个里程碑,该技术可以对数百万个DNA分子进行同时测序,从而使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,因此也称其为深度测序(deepsequencing)或下一代测序技术。Roche公司首先推出了基于焦磷酸测序法的高通量基因组测序系统。
该单细胞转录组测序技术的原理是酶级联化学发光反应:首先将PCR扩增的单链DNA与引物杂交,并与DNA聚合酶、ATP硫酸化酶、荧光素酶、ATP双磷酸酶、底物荧光素酶和57一磷酸硫酸腺苷共同孵育。在每一轮测序反应中只加入一种dNrP,若该dNr:瞪与模板配对,聚合酶就可以将其掺入到引物链中并释放出等摩尔数的焦磷酸。
焦磷酸盐被硫酸化酶转化为ATP,ATP就会促使氧合荧光素的合成并释放可见光。电荷耦合器件检测后通过软件转化为一个峰值.峰值与反应中掺人的核苷酸数目成正比m]。随后,IlluIIlina公司和ABI公司也相继推出了solexa和sOLiD测序技术。正如高通量测序技术在基因组测序中发挥了强大的作用,它也促进了转录组测序的发展。将以上高通量测序技术应用到由RNA逆转录生成的cDNA上,就产生了RnA.Seq技术。
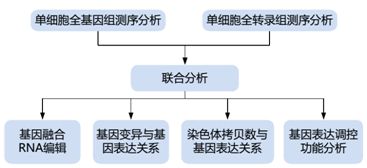
2单细胞转录组测序技术的应用
2.1肿瘤和循环肿瘤细胞
2011年,来自冷泉港实验室的Navin等[拍]运用一种单细胞测序,通过基于拷贝数变异的数据结果分析了乳腺癌的癌细胞种群结构,指出肿瘤的进化可能是间断性的,挑战了传统的肿瘤渐进式演化模型。
2012年,深圳华大基因研究院将其自主研发的一种解析单细胞基因组的新方法应用于原发性血小板增多症和肾透明细胞癌的肿瘤内部遗传特征的研究。
此方法解决了之前用组织样本测序时无法解决的肿瘤高异质性难题,为从单核苷酸水平深人研究癌症发生、发展机制及其诊断、治疗提供了新的研究思路并开辟了新的研究方向。为了探究肿瘤的演化及遗传特性,研究人员对取自一例典型的Mj汜基因阴性原发性血小板增多症病人的90个单细胞进行了全外显子测序矧.通过分析,研究人员揭示了此原发性血小板增多症在肿瘤发生中遵循单克隆演化模型,并鉴定了一些与原发性血小板增多症的发生、发展相关的突变基因。
另外,研究人员为了更好地解析肾癌内部的遗传变异情况,运用此方法对一例肾癌进行了研究[龆]。他们发现此例肾癌并非由常见的两个突变基因Ⅵ扎和船尉棚导致,说明在病人群体中所鉴定的频发突变可能与肿瘤个体无关.同时也强调了在癌症分析和诊断过程中进行个性化治疗的重要性。循环肿瘤细胞是一种从肿瘤原发灶中脱落进入患者血液的肿瘤细胞,数量较少,但与肿瘤的转移和复发有着密切关系㈣。单细胞转录组测序为其转录组分析提供了工具。
例如Daniel等利用smaIt—seq技术对单个循环系统肿瘤细胞进行分析,利用各个细胞类型中微量的个体细胞找到了多个基因的不同表达,成功检测出前列腺淋巴结癌细胞中的大多数活跃基因,并发现了不同的基因表达模式和生物标记物。
2.2胚胎和器官发育
来自斯坦福大学的研究团队从一名40岁男性体内分离出91个精子,并对它们进行单细胞测序。研究人员通过比较这名男性的精子基因组序列和他的二倍体细胞基因组序列,观察到单倍体精子细胞染色体中哪些地方发生了重组。研究人员也在每个精子细胞中鉴定出25个一36个新的单核苷酸突变,这些突变在这名男性的二倍体细胞基因组中并不存在。这些随机突变是产生遗传变异的另一种方式。但是如果它们在基因组特定位点发生,那么它们能够产生有害的影响。单细胞转录组测序技术在早期胚胎发育方面也有所应用。例如Yall等[虬]从植入前胚胎和单个人类胚胎干细胞中选取了124个细胞,测定了它们的基因表达,并成功检测到22687个表达的基因,其中包括8701个长非编码RNA(10ngnon—codingRNA,lncRNA)。
2.3免疫系统
近年来,单细胞转录组测序技术开始被应用于免疫系统的研究当中。免疫细胞对抗原物质的应答反应具有复杂和不均一性的异质性特点,单细胞转录组测序技术有望在此方面揭示丰富的未知信息。近期Shalek等[娩]就对脂多糖诱导的树突状细胞应答反应进行了研究。脂多糖是革兰氏阴性细菌细胞壁中的一种成分,能够通过激活树突状细胞的ToⅡ样受体引发显著的转录组改变。研究者利用RNA转录5’末端转换机制技术对18个小鼠骨髓来源的树突状细胞进行了cDNA文库的构建,并进行测序分析,他们发现在单细胞水平上,树突状细胞的反应具有高度的异质性[32]。许多已知的炎症反应基因在部分细胞中被强烈激活,而在其他细胞中仅被低度激活或完全未被激活,并且进一步发现这种反应应答的异质性源于两个方面,一方面是树突状细胞的成熟状态,另一方面则是基因调控网络的随机性特征。
通过上述的实例,我们不难看出单细胞转录组测序技术在疾病研究等领域具有重大的应用价值。相信随着其技术的不断发展和完善,单细胞转录组测序技术可以揭示更多基因表达网络、异质性、随机性表达等相关信息,从而更加完善地揭示更多疾病的机理,为人类战胜疾病奠定理论基础。
3展望
近年来.单细胞转录组测序技术已经取得了较为明显的发展。被应用于诸多领域;从哺乳动物早期胚胎发育阶段的转录组分析,到组织器官的发育.再到免疫系统和肿瘤等研究领域都可以见到单细胞转录组测序的身影。它的广泛应用为科研人员研究细胞之间的异质性带来了希望,使人们对各种疾病的发病机理有了更为深刻和具体的认识。
为了使单细胞转录组测序技术能够在未来发挥更大的作用,还应当将其与其他技术相结合.例如细胞成像技术等。另外,单细胞转录组测序技术应当朝着更加高通量的方向发展,在未来实现不单单针对单个样品或细胞的大规模集成化的分析,从而大大节约时间和成本。由于目前的单细胞转录组测序技术的操作过程相对比较繁琐,过多的依赖实验人员的操作技术,使得该技术的效率和稳定性都有所欠缺,为此应当朝着自动化的方向进一步发展,争取实现整个过程的自动操作。
总之.相信随着单细胞转录组测序技术的不断发展,各技术环节的日臻完善,其必将在医疗卫生等领域取得更加丰硕的成果,成为人们治疗疾病、探索生命科学的一项必不可少的技术。